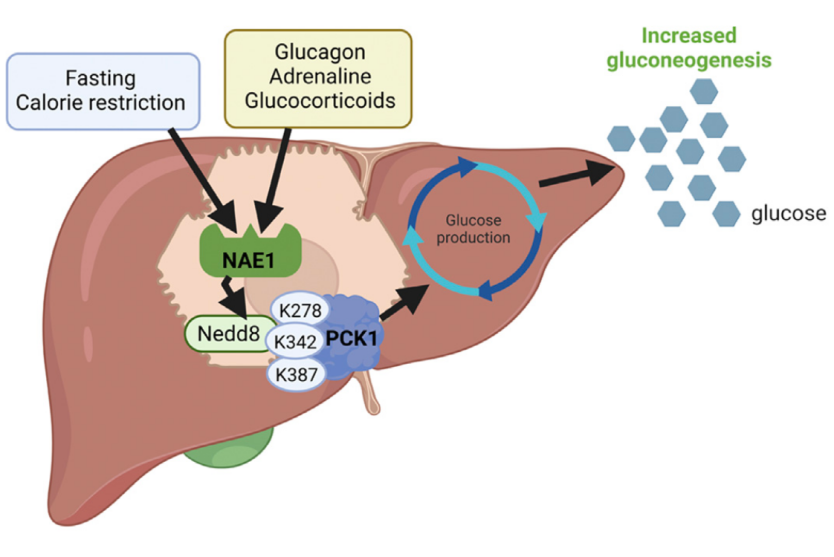
拟素化(Neddylation)是近年来发现的一种类似泛素化的蛋白质翻译后修饰过程,涉及泛素样分子NEDD8与蛋白质赖氨酸残基的共价结合,是蛋白质调控的重要机制【1】。拟素化广泛存在于真核细胞中,参与各种细胞过程,包括细胞分裂、细胞凋亡、信号传导和细胞粘附。拟素化过程由NEDD8激活酶 (NAE1)、NEDD8连接酶和E3连接酶催化。NEDD8激活酶将NEDD8活化为共价活性形式,NEDD8连接酶负责将NEDD8转移到蛋白质赖氨酸残基上,E3连接酶识别并选择目标蛋白,并促进NEDD8的共价结合。NEDD8共价结合到蛋白质后,可以通过多种方式调节蛋白质的活性。例如,NEDD8可以促进蛋白质的降解、调节蛋白质的磷酸化水平、调节蛋白质的局部定位。拟素化缺陷与多种疾病有关,包括癌症、神经退行性疾病和心血管疾病。葡萄糖是细胞能量的主要来源,禁食期间肝脏发生代谢重编程,利用糖异生途径动员非碳水化合物前体从头合成葡萄糖,以维持葡萄糖稳态并满足机体的能量需求。尽管有研究暗示拟素化在肝脏能量代谢、胰岛素信号转导、非酒精性脂肪肝发生及肝脏纤维化等过程中发挥了关键作用【2,3】,但拟素化信号通路是如何精细调控代谢适应性和葡萄糖代谢的,目前仍亟待阐明。2023年8月3日,西班牙圣地亚哥德孔波斯特拉大学(University of Santiago de Compostela)Ruben Nogueiras实验室领衔在Cell Metabolism杂志发表了题为 Neddylation of phosphoenolpyruvate carboxykinase 1 controls glucose metabolism 的研究论文,发现肝脏中的整体拟素化水平受营养状态的影响,抑制肝脏拟素化会降低禁食或能量限制后肝脏的糖异生能力。另一方面,2 型糖尿病患者肝脏中蛋白的整体拟素化程度上升,增强了磷酸烯醇式丙酮酸羧激酶(PCK1,糖异生限速酶)的K278、K342和K387残基的拟素化修饰,继而使底物更容易接近催化中心,促进了肝脏中葡萄糖的合成。本研究揭示了营养胁迫和(或)糖尿病发生时拟素化修饰调控葡萄糖代谢稳态的新机制。作者首先探究了营养适应性是否会影响拟素化水平,发现饥饿处理会上调小鼠肝脏拟素化程度,而重新饲喂会降低拟素化,该变化受到“瘦素-受体”依赖性机制的介导。靶向NAE1或NEDD8抑制肝脏拟素化后,小鼠糖异生能力下降而导致血糖水平降低。此外,禁食后抑制肝脏拟素化并不会改变糖异生酶或乙酰辅酶A水平,且肝脏中糖异生的重要底物氨基酸的量并没有随拟素化降低而发生变化。鉴于抑制肝脏拟素化会降低糖异生活性,因此作者进一步探究了拟素化是否参与了葡萄糖拮抗反应的调控,发现拟素化介导葡萄糖拮抗激素(胰高血糖素、肾上腺素和糖皮质激素)的作用,并且是肝脏糖异生所必需的,肝脏中激活拟素化能够促进糖异生并抑制胰岛素的降血糖作用。糖尿病患者中胰岛素对肝脏糖异生的抑制作用失效,导致空腹和餐后高血糖【4】。作者检测了肥胖伴2型糖尿病患者和血糖正常的肥胖成年人的肝脏拟素化水平,发现肥胖伴2型糖尿病患者的肝脏拟素化程度上升,且不存在性别偏好性。为了阐明拟素化是如何影响葡萄糖代谢的,作者接下来利用拟素化蛋白质组学技术鉴定了糖异生诱导状态下肝脏蛋白拟素化的变化图谱。结果表明,61种蛋白的拟素化修饰程度在营养胁迫后发生了改变,且显著富集于糖异生通路,其中以糖异生反应的限速酶PCK1为代表。具体来说,PCK1在营养胁迫时与NAE1的结合活性提高,进而被高度拟素化,并且该修饰是PCK1介导糖异生反应活性所必需的。接下来作者利用免疫沉淀和串联质谱鉴定了PCK1的拟素化位点,发现位于PCK1表面的K278、K342和K387赖氨酸残基在饥饿状态下能够被拟素化修饰,且这3个残基在体内和体外条件下均对PCK1调控糖异生反应和小鼠血糖稳态至关重要。综上所述,本研究发现受营养胁迫(禁食或热量限制)的小鼠肝脏和2 型糖尿病患者的肝脏中拟素化修饰水平上调,并且会诱导糖异生反应限速酶PCK1的K278、K342 和 K278残基发生拟素化,进而将催化中心周围的两个环重新定位为开放结构,使底物更容易接近催化中心,促进了葡萄糖的合成。本研究揭示了糖异生限速酶PCK1的拟素化修饰通过整合整体营养供应与代谢稳态,精确调控了肝脏的葡萄糖代谢。https://doi.org/10.1016/j.cmet.2023.07.003
1.Enchev R I, et al. (2015). Protein neddylation: beyond cullin–RING ligases. Nat. Rev. Mol. Cell Biol, 16(1): 30-44.
2.Serrano-Macia, et al. (2021). Neddylation inhibition ameliorates steatosis in NAFLD by boosting hepatic fatty acid oxidation via the DEPTOR-mTOR axis. Mol. Metab. 53, 101275.
3.Zubiete-Franco, I., et al. (2017). Deregulated neddylation in liver fibrosis. Hepatology 65, 694–709.
4.Magnusson, I., Rothman, D.L., Katz, L.D., Shulman, R.G., and Shulman, G.I. Increased rate of gluconeogenesis in type II diabetes mellitus. A 13C nuclear magnetic resonance study. J. Clin. Invest. 1992, 90, 1323–1327.